Alam semesta terdiri atas planet-planet, contohnya bumi. Di bumi terdapat gunung, udara, laut, dan begitu banyak hal lain. Segala sesuatu yang berada di bumi tersusun atas materi, yang terdiri atas unsur, seperti air, udara, tanah, dan api. Itulah gambaran keragaman materi.
1. Klasifikasi Materi
Ketika kita mengumpulkan sekelompok benda berdasarkan sifatnya, langkah-langkah yang dapat dilakukan adalah sebagai berikut.
- Mengamati karakteristik benda tersebut.
- Mencatat persamaan dan perbedaan sifat benda masing–masing.
- Memasukkan benda-benda yang memiliki persamaan sifat ke dalam satu kelompok.
- Memberi nama yang sesuai pada setiap kelompok benda tersebut.
Apabila kita perhatikan sebuah lampu bohlam. Tersusun dari materi apa sajakah lampu tersebut? Para ilmuwan mengklasifikasi materi agar lebih mudah dipelajari dan disusun secara sistematis. Materi adalah sesuatu yang mempunyai massa dan dapat menempati sebuah ruang. Materi berdasarkan wujudnya dapat dikelompokkan menjadi zat padat, cair, dan gas. Contoh zat padat adalah beberapa jenis logam, seperti besi, emas, dan seng. Air, minyak goreng, dan bensin merupakan contoh wujud cair. Sedangkan contoh zat berwujud gas adalah udara, asap, dan uap air.

Contoh wujud zat yang sederhana dan mudah kita pahami adalah air. Ketika dalam bentuk bongkahan es, maka es tersebut dikatakan dalam wujud padat. Tetapi, ketika dipanaskan es tersebut akan berubah kembali menjadi air. Air tersebut dikatakan dalam wujud cair. Ketika dipanaskan pada suhu 100°C, air akan berubah menjadi uap air. Uap air dikatakan dalam wujud gas. Perbedaan sifat zat padat, cair, dan gas dijelaskan pada tabel dibawah ini;

2. Unsur, Senyawa, dan Campuran
Unsur merupakan zat tunggal yang tidak dapat diuraikan lagi menjadi zat yang lebih sederhana dengan proses kimia biasa. Semua benda yang ada di bumi kita tersusun dari materi. Ilmuwan menggolongkan materi berdasarkan komposisi dan sifatnya. Berdasarkan komposisinya, materi yang ada di alam dapat diklasifikasi menjadi zat tunggal dan campuran. Perhatikan gambar dibawah ini;

Dari gambar diatas dapat terlihat bahwa materi di alam dapat dibagi menjadi zat tunggal (murni) dan campuran. Bila kita kaji lebih mendalam lagi, zat tunggal (murni) yang ada di alam dapat dibagi menjadi unsur dan senyawa. Unsur merupakan zat tunggal yang tidak dapat dibagi lagi menjadi bagian yang lebih sederhana dan akan tetap mempertahankan karakteristik asli dari unsur tersebut. Sebongkah emas apabila dibagi terus sampai bagian yang terkecil akan menjadi atom emas.
Banyak sekali unsur yang ada di alam dapat kita jumpai dalam kehidupan sehari-hari. Misalnya besi, timah, seng, tembaga, dan nikel. Sama dengan contoh emas di atas, jika diperhatikan potongan besi bila dibagi lagi menjadi bagian yang terkecil akan diperoleh atom besi. Demikian pula pada timah, seng, tembaga, dan nikel. Dari penjabaran tersebut, maka dapat disimpulkan bahwa unsur merupakan zat tunggal yang tidak dapat diuraikan lagi menjadi zat yang lebih sederhana dengan proses kimia biasa. Bagian terkecil dari unsur adalah atom.
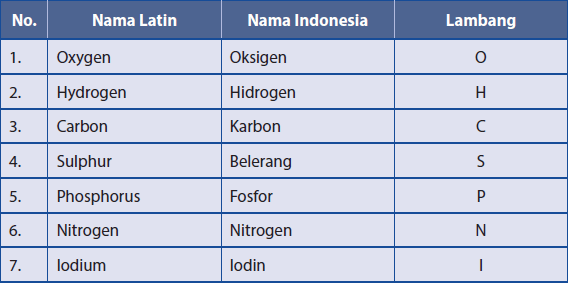
Lalu ketika kita belajar alat musik, tentu saja kita harus mempelajari simbol-simbol musik atau not baloknya. Simbol-simbol tersebut dapat dibaca dan dipelajari oleh semua orang, sehingga semua orang dapat mempelajarinya dengan mudah. Demikian halnya dengan para ahi kimia. Ahli kimia juga menggunakan simbol atau lambang untuk menunjukkan perbedaan antara unsur kimia yang satu dengan yang lainnya. Ahli kimia sudah menemukan unsur sejak abad ke-9 dan unsur secara bertahap terus berkembang sampai abad ke-20. Unsur di alam dapat dibagi menjadi dua jenis, yaitu unsur logam dan nonlogam. Contoh unsur logam adalah besi, emas, dan seng. Contoh unsur nonlogam adalah karbon, nitrogen, dan oksigen. Selain itu masih ada juga unsur yang bersifat semi logam. Berikut ini disajikan beberapa contoh unsur logam dan nonlogam yang dikenal dalam kehidupan sehari-hari beserta lambangnya.
Simbol unsur dibuat untuk memudahkan dalam penulisan nama unsur, yaitu dengan cara menyingkatnya. Simbol unsur yang saat ini digunakan secara internasional adalah simbol unsur yang diusulkan oleh Jöns Jacob Berzelius.
Cara pemberian lambang unsur menurut Berzelius adalah sebagai berikut.
Banyak sekali unsur yang ada di alam dapat kita jumpai dalam kehidupan sehari-hari. Misalnya besi, timah, seng, tembaga, dan nikel. Sama dengan contoh emas di atas, jika diperhatikan potongan besi bila dibagi lagi menjadi bagian yang terkecil akan diperoleh atom besi. Demikian pula pada timah, seng, tembaga, dan nikel. Dari penjabaran tersebut, maka dapat disimpulkan bahwa unsur merupakan zat tunggal yang tidak dapat diuraikan lagi menjadi zat yang lebih sederhana dengan proses kimia biasa. Bagian terkecil dari unsur adalah atom.
Lalu ketika kita belajar alat musik, tentu saja kita harus mempelajari simbol-simbol musik atau not baloknya. Simbol-simbol tersebut dapat dibaca dan dipelajari oleh semua orang, sehingga semua orang dapat mempelajarinya dengan mudah. Demikian halnya dengan para ahi kimia. Ahli kimia juga menggunakan simbol atau lambang untuk menunjukkan perbedaan antara unsur kimia yang satu dengan yang lainnya. Ahli kimia sudah menemukan unsur sejak abad ke-9 dan unsur secara bertahap terus berkembang sampai abad ke-20. Unsur di alam dapat dibagi menjadi dua jenis, yaitu unsur logam dan nonlogam. Contoh unsur logam adalah besi, emas, dan seng. Contoh unsur nonlogam adalah karbon, nitrogen, dan oksigen. Selain itu masih ada juga unsur yang bersifat semi logam. Berikut ini disajikan beberapa contoh unsur logam dan nonlogam yang dikenal dalam kehidupan sehari-hari beserta lambangnya.
Unsur logam dan lambangnya
Unsur nonlogam dan lambangnya
Unsur diberi nama dengan menggunakan bahasa Latin berdasarkan penemu pertamanya atau tempat ditemukannya unsur tersebut. Ahli-ahli kimia tidak membedakan penamaan unsur alamiah yang terdapat di alam ataupun unsur buatan. Beberapa unsur menggunakan nama untuk menghormati identitas penemunya ataupun tempat penemuannya.Simbol unsur dibuat untuk memudahkan dalam penulisan nama unsur, yaitu dengan cara menyingkatnya. Simbol unsur yang saat ini digunakan secara internasional adalah simbol unsur yang diusulkan oleh Jöns Jacob Berzelius.
Cara pemberian lambang unsur menurut Berzelius adalah sebagai berikut.
- Setiap unsur dilambangkan dengan satu huruf, yaitu huruf awal dari nama latinnya.
- Huruf awal ditulis dengan huruf kapital atau huruf besar.
- Untuk unsur yang memiliki huruf awal sama, diberikan satu huruf kecil dari nama unsur tersebut.
Contoh:
Karbon (nama latinnya Carbon), dilambangkan dengan (C), Kalsium (nama latinnya Calsium) dilambangkan dengan (Ca).
Unsur-unsur tersebut selanjutnya disusun dalam bentuk sistem periodik unsur, Unsur-unsur yang memiliki sifat yang hampir sama diletakkan dalam satu kolom. Unsur-unsur logam terletak di bagian kiri bawah (diberi simbol warna biru), unsur-unsur nonlogam terletak di bagian kanan atas (diberi simbol warna kuning), sedangkan unsur semilogam (diberi warna cokelat) di antara warna biru dan kuning.
 |
| Tabel Periodik Unsur |
Unsur logam dan nonlogam memiliki perbedaan sifat fisika dan kimia. Berikut perbedaan sifat unsur logam dan nonlogam.
Perbedaan unsur logam dan nonlogam
Jika kita perhatikan, baik unsur logam maupun nonlogam memiliki banyak kegunaan dalam kehidupan sehari-hari. Contohnya besi dan tembaga, banyak digunakan untuk alat-alat perkakas, alat-alat rumah tangga, dan bahan untuk rangka kendaraan. Unsur Iodium banyak digunakan sebagai antiseptik. Beberapa kegunaan dari beberapa unsur diperlihatkan pada Tabel berikut.
Unsur logam dan nonlogam serta kegunaannya
b. Senyawa
Dalam kehidupan sehari-hari, kita sering menggunakan air, gula, garam, asam cuka, dan beberapa bahan lainnya. Bahan-bahan tersebut merupakan senyawa. Kita telah mengetahui, bahwa bagian terkecil dari sebuah unsur adalah atom. Dua atau lebih atom dapat bergabung melalui reaksi kimia dan membentuk molekul. Molekul merupakan bagian terkecil dari suatu senyawa. Dengan demikian, senyawa terdiri atas dua buah unsur atau lebih. Suatu senyawa masih dapat diuraikan menjadi unsur-unsurnya. Dari uraian tersebut, dapat dijelaskan bahwa senyawa merupakan zat tunggal/murni yang dapat diuraikan menjadi dua atau lebih zat yang lebih sederhana dengan proses kimia biasa. Misalnya, air yang memiliki rumus H2O dapat diuraikan menjadi unsur hidrogen (H) dan oksigen (O).
Bagaimana suatu senyawa dapat terbentuk? Senyawa terbentuk melalui proses pencampuran unsur secara kimia. Sifat suatu senyawa akan berbeda dengan sifat unsur- unsur penyusunnya. Misalnya, sifat air sebagai senyawa akan berbeda dengan sifat gas hidrogen dan oksigen sebagai unsur penyusunnya. Pada suhu kamar air berwujud cair, sedangkan hidrogen dan oksigen, keduanya berwujud gas. Air dapat digunakan untuk memadamkan api, sedangkan gas hidrogen merupakan zat yang mudah terbakar dan gas oksigen merupakan zat yang diperlukan dalam pembakaran.
Contoh senyawa sederhana dan unsur penyusunnya
c. Campuran
Campuran adalah suatu materi
yang terdiri atas dua zat atau lebih yang masih mempunyai sifat zat asalnya. Campuran dibedakan menjadi dua, yaitu campuran homogen dan campuran heterogen. Contoh beberapa campuran yang sering kita jumpai dalam kehidupan sehari-hari adalah susu cokelat, air sungai, udara, batuan, garam beryodium, dan paduan logam. Kamu mungkin sering menggunakan berbagai jenis campuran, misalnya ketika memasak, membuat teh manis atau kopi.
1) Campuran Homogen
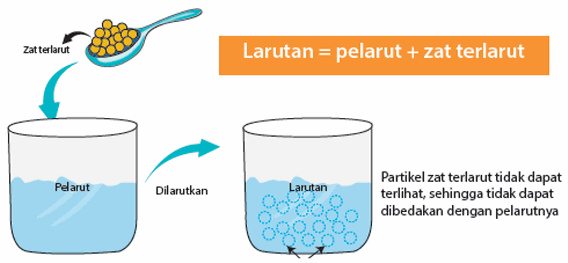
Campuran homogen adalah campuran yang tidak dapat dibedakan zat- zat yang tercampur di dalamnya. Campuran homogen banyak kita jumpai dalam kehidupan sehari-hari. Larutan gula, larutan garam, dan sirop merupakan contoh campuran homogen. Dalam larutan gula, kita tidak dapat membedakan zat-zat penyusunnya.
Larutan tersusun atas pelarut (solvent) dan zat terlarut (solute). Pelarut yang banyak digunakan adalah air. Senyawa lain yang dapat digunakan sebagai pelarut adalah senyawa organik yang dikenal juga sebagai pelarut organik , contohnya kloroform. Dalam larutan, ukuran partikel zat terlarut sangat kecil dengan diameter kurang dari 1 nm sehingga partikel zat terlarut tidak dapat dilihat walaupun menggunakan mikroskop ultra. Oleh karena itu, larutan terlihat homogen (serba sama). Artinya zat yang terlarut dan pelarut dalam larutan tersebut tidak dapat dibedakan.
a) Larutan Asam, Basa, dan Garam
Pada dasarnya, larutan yang dikenal dalam kehidupan sehari-hari dapat dikelompokkan menjadi larutan yang bersifat asam, basa, atau garam. Larutan seperti cuka, sirop, penghilang noda, sabun cuci, sabun mandi, soda kue, dan garam dapur merupakan contoh larutan asam, larutan basa, atau garam yang banyak dijumpai setiap hari. Larutan asam dan basa dimanfaatkan secara luas untuk industri, pertanian, kesehatan, dan penelitian di laboratorium. Oleh karena itu, dalam memahami sifat-sifat asam dan basa merupakan hal yang sangat penting untuk memahami berbagai macam jenis larutan yang dijumpai dalam kehidupan sehari-hari.
(1) Asam
Asam banyak ditemukan dalam buah-buahan dan sayuran. Contohnya, jeruk, lemon, dan tomat. Pada saat memasak di dapur, tentu kita mengenal salah satu bahan penambah rasa makanan, yaitu cuka dapur yang mengandung asam asetat. Aki pada kendaraan bermotor mengandung asam sulfat. Asam dalam lambung kita, yaitu asam klorida berfungsi membantu proses pencernaan bahan makanan. Masih banyak contoh senyawa asam lainnya yang dikenal dalam kehidupan sehari-hari. Kita dapat menemukan larutan asam, baik dalam makanan, minuman, ataupun bahan pembersih di rumah. Dari beberapa contoh larutan asam yang dijumpai dalam kehidupan sehari-hari, bagaimana cara kita mengidentifikasi larutan asam? Berikut ciri atau tanda dari larutan asam.
- (a) Rasanya masam (tidak boleh dicoba kecuali dalam makanan).
- (b) Dapat menimbulkan korosi.
- (c) Mengubah kertas lakmus biru menjadi merah.
Selain banyak dimanfaatkan dalam kehidupan sehari-hari, larutan asam dapat menimbulkan dampak negatif bagi lingkungan, contohnya terjadinya hujan asam. Di beberapa wilayah tertentu, terjadi hujan asam yang menyebabkan kerusakan pada bangunan gedung dan patung-patung dalam kota. Mengapa dapat terjadi hujan asam? Bila terdapat kadar gas belerang dioksida (SO2) dan nitrogen oksida (NO) di atmosfer sangat tinggi, maka gas ini akan bereaksi dengan air di atmosfer dan membentuk asam sulfat, asam nitrat, dan senyawa asam lainnya. Ketika terjadi hujan, air yang dihasilkan bersifat lebih asam dari keadaan normal. Air hujan inilah yang dikenal dengan hujan asam. Gas belerang dioksida dan gas nitrogen oksida dihasilkan dari pembakaran minyak bumi yang berasal dari buangan industri dan kendaraan bermotor. Selain merusak gedung dan patung-patung, hujan asam tersebut dapat merusak tumbuh-tumbuhan dan dapat menyebabkan kematian pada makhluk hidup yang ada di sungai apabila hujan asam tersebut masuk ke sungai.
(2) Basa
Basa merupakan larutan yang banyak dijumpai dalam kehidupan sehari-hari. Contoh benda yang mengandung basa ialah sabun mandi, sabun cuci, sampo, pasta gigi, obat mag, dan pupuk. Dalam penggunaan sehari-hari, umumnya basa dicampur dengan zat lain. Bagaimana cara kita mengidentifikasi larutan basa? Berikut adalah sifat-sifat basa.
- a. Mempunyai rasa agak pahit (tidak boleh dicoba).
- b. Terasa licin di kulit.
- c. Mengubah kertas lakmus merah menjadi biru.
Dalam kehidupan sehari-hari, larutan asam sering direaksikan dengan larutan basa untuk menghasilkan senyawa netral atau dikenal dengan reaksi netralisasi. Pada reaksi netralisasi ini akan dihasilkan garam dan air. Contoh penerapan reaksi netralisasi dalam kehidupan sehari-hari adalah untuk pengobatan bagi penderita sakit mag. Di mana sakit mag (kondisi kadar asam lambung yang tinggi) maka obat mag adalah senyawa yang bersifat basa (kandungannya magnesium hidroksida atau aluminium hidroksida). Contoh lainnya adalah pengobatan akibat sengatan serangga, perlindungan terhadap kerusakan gigi, dan pengolahan tanah pertanian.
b) Indikator
Larutan asam dan larutan basa memiliki sifat-sifat yang khas. Salah satu cara untuk membedakan asam atau basa dapat menggunakan indikator. Suatu indikator asam-basa adalah suatu senyawa yang dapat menunjukkan perubahan warna apabila bereaksi dengan asam atau basa. Indikator asam-basa dapat dibedakan menjadi indikator alami dan indikator buatan.
(1) Indikator Alami
Berbagai jenis tumbuhan dapat digunakan sebagai indikator alami. Tumbuhan yang termasuk indikator alami akan menunjukkan perubahan warna pada larutan asam ataupun basa. Beberapa contoh tumbuhan yang dapat digunakan sebagai indikator alami adalah kunyit, bunga mawar, kubis merah, kubis ungu, dan bunga kembang sepatu. Ekstrak kunyit akan memberikan warna kuning cerah pada larutan asam dan dalam larutan basa akan memberikan warna jingga. Kubis (kol) merah mengandung suatu zat indikator, yaitu antosianin. Zat ini berwarna merah pada asam, berwarna hijau pada basa lemah, dan berwarna kuning pada basa kuat. Ekstrak bunga kembang sepatu akan memberikan warna merah cerah jika diteteskan dalam larutan asam. Jika diteteskan dalam larutan basa akan dihasilkan warna hijau.
(2) Indikator buatan
Salah satu jenis indikator buatan yang bukan dalam bentuk larutan cair adalah kertas lakmus. Ada dua jenis kertas lakmus, yaitu lakmus biru dan lakmus merah. Warna kertas lakmus biru akan menjadi merah dalam larutan asam. Warna kertas lakmus merah akan menjadi biru dalam larutan basa. Perhatikan perubahan warna kertas lakmus pada gambar di bawah ini.
c) Garam
Jenis senyawa garam yang paling dikenal adalah garam dapur atau nama senyawa kimianya natrium klorida (NaCl). Garam ini banyak digunakan dalam pengolahan makanan. Bagaimana senyawa garam dapat terbentuk? Salah satu reaksi yang dapat membentuk garam adalah reaksi asam dan basa atau reaksi netralisasi. Pada reaksi netralisasi tersebut akan dihasilkan garam dan air.
Asam + Basa →Garam + Air
Garam secara luas digunakan dalam kehidupan sehari-hari, antara lain untuk industri pupuk, obat-obatan, pengolahan makanan, dan bahan pengawet. Contoh reaksi asam dan basa yang membentuk berbagai jenis garam adalah:
HCl + NaOH → NaCl + H2O
Asam klorida + Natrium hidroksida → Garam NaCl + air
2) Campuran Heterogen
Campuran pasir dan air merupakan salah satu contoh dari campuran heterogen. Campuran heterogen terjadi karena zat yang tidak dapat bercampur satu dengan lain secara sempurna sehingga dapat dikenali zat penyusunnya. Dengan demikian, pada campuran heterogen, seluruh bagiannya tidak memiliki komposisi yang sama (tidak serba sama).
Dari uraian diatas, berikut disajikan Perbedaan sifat unsur, senyawa , dan campuran.







0 Response to "Cara Mengklasifikasikan Materi"
Post a Comment